ثنائي ميثيل الزئبق Dimethylmercury
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Dimethylmercury[1]
| |
| أسماء أخرى
Mercury dimethanide
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| مرجع بايلستاين | 3600205 |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.916 |
| رقم EC |
|
| مرجع Gmelin | 25889 |
| عناوين مواضيع طبية MeSH | |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
| UN number | 2929 |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
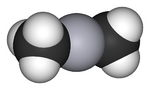
| الصيغة الجزيئية | C 2H 6Hg (CH 3) 2Hg |
| كتلة مولية | 230.66 ج. مول −1 |
| المظهر | سائل عديم اللون |
| الرائحة | حلو المذاق |
| الكثافة | 2.961 g mL−1 |
| نقطة الانصهار | |
| نقطة الغليان | |
| معامل الانكسار (nD) | 1.543 |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
57.9–65.7 ك.ج. مول −1 |
| المخاطر | |
| خطر رئيسي | مادة ملوثة للبيئة شديدة الاشتعال، شديدة السمية، ومستمرة |
| ن.م.ع. مخطط تصويري |    
|
| ن.م.ع. كلمة الاشارة | DANGER |
| H224, H300+H310+H330, H370, H372, H410 | |
| P260, P264, P273, P280, P284, P301+P310 | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | 5 °C (41 °F; 278 K) |
| مركبات ذا علاقة | |
أنيونات أخرى
|
|
كاتيونات أخرى
|
|
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
ثنائي ميثيل الزئبق (Dimethylmercury)، هو مركب زئبق عضوي شديد السمية صيغته الكيميائية (CH3)2Hg. ثنائي ميثيل الزئبق هو سائل متطاير، قابل للاشتعال، كثيف، عديم اللون، وهو من أقوى السموم العصبية المعروفة. أقل من 0.1 مل منه قادرة على إحداث تسمم شديد بالزئبق، مما يؤدي إلى الوفاة.[2]
التحضير، التركيب، والتفاعلات
كان هذا المركب من أقدم المركبات العضوية الفلزية التي تم رصدها، مما يعكس ثباته الكبير. حضّره جورج بكتون لأول مرة عام 1857 بتفاعل يوديد ميثيل الزئبق مع سيانيد البوتاسيوم:[3]
- 2 CH3HgI + 2 KCN → Hg(CH3)2 + 2 KI + (CN)2 + Hg
وفي وقت لاحق، اكتشف إدوارد فرانكلاند أنه من الممكن تحضيره عن طريق معالجة ملغمة الصوديوم مع هاليدات الميثيل:
يمكن أيضاً الحصول عليه عن طريق ألكلة كلوريد الزئبق مع ميثيل الليثيوم:
- HgCl2 + 2 LiCH3 → Hg(CH3)2 + 2 LiCl
يتخذ الجزيء بنية خطية مع أطوال روابط Hg–C تبلغ 2.083 Å.[4]
الخصائص التفاعلية والفيزيائية
يعتبر ثنائي ميثيل الزئبق مستقراً في الماء ويتفاعل مع الأحماض المعدنية بمعدل كبير فقط في درجات الحرارة المرتفعة،[5][6] بينما تتحلل مركبات الكادميوم العضوي والزنك العضوي المقابلة (ومعظم الألكيلات الفلزية عموماً) بسرعة. يعكس هذا الفرق ارتفاع الكهرسلبية للزئبق (Pauling EN = 2.00) وانخفاض ألفة الزئبق الثنائي (Hg(II)) لربيطات الأكسجين. يخضع المركب لتفاعل إعادة توزيع مع كلوريد الزئبق لإنتاج كلوريد ميثيل الزئبق.
- (CH3)2Hg + HgCl2 → 2 CH3HgCl
في حين أن ثنائي ميثيل الزئبق هو سائل متطاير، فإن كلوريد ميثيل الزئبق هو مادة صلبة بلورية.[7]
الاستخدام
تطبيقات ثنائي ميثيل الزئبق العملية قليلة نظراً لخطورته على حياة البشر. دُرست تفاعلاته لربط كاتيونات ميثيل الزئبق بالجزيئات المستهدفة، مما يُشكل مُبيدات بكتيريا قوية، إلا أن تراكم ميثيل الزئبق الحيوي وسميته القصوى أدى إلى التخلي عنه بشكل كبير لصالح مركبات إيثيل الزئبق وثنائي إيثيل الزئبق الأقل سمية، والتي تؤدي وظيفة مماثلة دون خطر التراكم الحيوي.[بحاجة لمصدر]
في علم السموم، لا يزال استخدامه محدوداً كسُمّ مرجعي. كما يُستخدم لمعايرة أجهزة الرنين المغناطيسي النووي (NMR) للكشف عن الزئبق (δ 0 ppm for 199Hg NMR)، على الرغم من أن ثنائي إيثيل الزئبق وأملاح الزئبق الأقل سمية تُفضّل الآن.[8][9][10]
حوالي عام 1960، اقترح فيل پومرانتز، وهو موظف في مكتب الأسلحة البحرية، استخدام ثنائي ميثيل الزئبق كمزيج وقود مع حمض النيتريك أحمر الدخان.[11] لم يتم القيام بذلك مطلقاً، على الرغم من أنه أدى إلى اختبار صاروخ حمض النيتريك أحمر الدخان - ثنائي ميثيل هيدرازين غير متماثل مع حقن عنصر الزئبق في غرفة الاحتراق في محطة اختبار الذخائر البحرية.[11]
السلامة
ثنائي ميثيل الزئبق سام للغاية والتعامل معه خطير. امتصاص جرعات منخفضة تصل إلى 0.1 مل قد يؤدي إلى تسمم حاد بالزئبق.[2] تزداد المخاطر بسبب ارتفاع ضغط البخار للمركب.[2] نظراً لكونه شديد الألفة للدهون، فإنه يمتص من خلال الجلد إلى دهون الجسم بسهولة شديدة ويمكنه اختراق العديد من المواد، بما في ذلك العديد من المواد البلاستيكية والمطاطية.[بحاجة لمصدر]
أظهرت اختبارات النفاذية أن العديد من أنواع القفازات التي تستخدم لمرة واحدة المصنوعة من المطاط أو الپولي ڤينيل كلوريد (عادةً، يبلغ سمكها حوالي 0.1 مم)، والتي تُستخدم عادةً في معظم المعامل والإعدادات السريرية، لديها معدلات عالية وقصوى من نفاذية ثنائي ميثيل الزئبق في غضون 15 ثانية.[12] تنصح إدارة السلامة والصحة المهنية الأمريكية (OSHA) بالتعامل مع ثنائي ميثيل الزئبق باستخدام قفازات مغلفة عالية المقاومة مع زوج إضافي من القفازات المقاومة للتآكل يتم ارتداؤها فوق زوج القفازات المغلفة، كما توصي أيضاً باستخدام واقي للوجه والعمل في غطاء الدخان.[2][13]
يتم استقلاب ثنائي ميثيل الزئبق بعد عدة أيام إلى ميثيل الزئبق.[12] يعبر ميثيل الزئبق الحاجز الدموي الدماغي بسهولة، ربما بسبب تكوين معقد تساندي مع السيستين.[13] يمتصه الجسم بسهولة ويميل إلى التراكم الحيوي. قد تتأخر أعراض التسمم بالزئبق لأشهر، مما يؤدي إلى اكتشاف التشخيص في النهاية، لكن فقط عند نقطة يكون فيها الوقت قد فات أو كاد يفوت لنجاح نظام علاج فعال.[13] يُعرف التسمم بالزئبق الميثيل أيضًا باسم مرض ميناماتا.
حوادث

- في وقت مبكر من عام 1865، توفي عاملان في معمل إدوارد فرانكلاند بعد ظهور أعراض عصبية متقدمة عليهما في أعقاب التعرض العرضي للمركب.[3]
- توفيت كارين ويترهان، أستاذة الكيمياء في كلية دارتموث، عام 1997، بعد عشرة أشهر من انسكاب بضع قطرات فقط من ثنائي ميثيل الزئبق على قفازاتها المطاطية.[2][14] أدى هذا الحادث إلى زيادة الوعي بسُمية هذه المادة الشديدة، وقدرتها على اختراق القفازات المطاطية بسهولة، مقارنةً بالمواد الأقل مسامية مثل النتريل. نُشرت إرشادات جديدة من إدارة السلامة والصحة المهنية للتعامل مع المواد، وتخلصت العديد من المؤسسات من مخزوناتها من هذا المركب، وأصبح من المستحيل تقريباً شراءه.[15]
- كريستوف بولوين، وهو ألماني يبلغ من العمر 40 عاماً، وكان مسؤول قاعدة بيانات في شركة آي جي برگباو، كيمي، إنرجي، ادعى تعرضه لهجوم بمظلة بلغارية ذات رأس محقنة في 15 يوليو 2011 في هانوڤر، ألمانيا. وكان بولوين، الذي توفي بعد عام جراء التسمم بالزئبق، قد صرح بأنه صادر المحقنة، التي تبين لاحقاً أنها تحتوي على ثنائي ميثيل الزئبق.[16][17][18] وفقاً لمقال نُشر عام 2020 في مجلة "الطب الشرعي، الطب وعلم الأمراض"، كشفت تحقيقات الشرطة عن وجود حقنة تحتوي على مركب ثاليوم زئبقي نموذجي في سيارة بولوين، وزئبق وثاليوم في موازين الحرارة في محل عمله. أثارت تحاليل الدم والبول والأنسجة غير الحاسمة قبل الوفاة وبعدها شكوكاً حول رواية الاعتداء. أدى غياب هوية المعتدي أو دوافعه، بالإضافة إلى وجود مركبات زئبقية مختلفة في سيارة بولوين، إلى استنتاج الشرطة أن التسمم كان على الأرجح ذاتياً، مما أنهى التحقيق الأولي.[19] إن رواية مجلة الطب الشرعي تتناقض مع تقارير أخرى، بما في ذلك حلقة 24 أغسطس 2022 من برنامج الجريمة الحقيقية الرائد في ألمانيا "Aktenzeichen XY... ungelöst" الذي شارك في إعداده شرطة هانوڤر الجنائية والذي تم فيه طلب معلومات من الجمهور بناءً على سيناريو بولوين الخاص.[20]
انظر أيضاً
المصادر
- ^ "dimethylmercury – Compound Summary". PubChem Compound. US: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. Retrieved 2021-01-29.
- ^ أ ب ت ث ج "OSHA Hazard Information Bulletins – Dimethylmercury". OSHA.gov. Retrieved 2021-01-29.
- ^ أ ب McAuliffe, C. A., ed. (1977). The Chemistry of mercury. London: Macmillan. ISBN 978-1-349-02489-6. OCLC 1057702183.[صفحة مطلوبة]
- ^ Holleman, A. F.; Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (4th ed.). Hoboken, N.J.: John Wiley. p. 424. ISBN 0471662569. OCLC 61520528.
- ^ Baughman, George L.; Gordon, John A.; Wolfe, N. Lee; Zepp, Richard G. (September 1973). Chemistry of Organomercurials in Aquatic Systems. United States Environmental Protection Agency Ecological Research Series. U.S. Govt. Print. Off. pp. 34–40. Retrieved 2021-01-29.
- ^ "Methylmercury chloride". PubChem. National Center for Biotechnology Information, United States National Institutes of Health. Retrieved 2021-01-29.
- ^ O'Halloran, T. V.; Singer, C. P. (1998-03-10). "199Hg Standards". Northwestern University. Archived from the original on 2005-05-14. Retrieved 2021-01-20.
- ^ Hoffman, R. (2011-08-01). "(Hg) Mercury NMR". Jerusalem: The Hebrew University. Retrieved 2021-01-29.
- ^ "Delayed Toxic Syndromes" (PDF). Terrorism by Fear and Uncertainty. ORAU. Archived from the original (PDF) on 2012-04-23. Retrieved 2021-01-29.
- ^ أ ب Clark, John Drury (2018-05-23). Ignition!. New Brunswick: Rutgers University Press Classics. pp. 177–179. ISBN 978-0-8135-9583-2.
- ^ أ ب Nierenberg, David W.; Nordgren, Richard E.; Chang, Morris B.; Siegler, Richard W.; Blayney, Michael B.; Hochberg, Fred; Toribara, Taft Y.; Cernichiari, Elsa; Clarkson, Thomas (1998). "Delayed Cerebellar Disease and Death after Accidental Exposure to Dimethylmercury". New England Journal of Medicine. 338 (23): 1672–1676. doi:10.1056/NEJM199806043382305. PMID 9614258.
- ^ أ ب ت Cotton, Simon (October 2003). "Dimethylmercury and Mercury Poisoning: The Karen Wetterhahn story". Molecule of the Month. Bristol University School of Chemistry. doi:10.6084/m9.figshare.5245807. Retrieved 29 January 2021.
- ^ "DimethylMercury and Mercury poisoning". Molecule of the Month www.chm.bris.ac.uk. October 2003. Retrieved 2022-08-25.
- ^ Cavanaugh, Ray (2019-02-19). "The dangers of dimethylmercury". Chemistry World. Royal Society of Chemistry. Retrieved 29 January 2021.
- ^ Albers, Anne; Gies, Ursula; Raatschen, Hans-Jurgen; Klintschar, Michael (2020-09-01). "Another umbrella murder? – A rare case of Minamata disease". Forensic Science, Medicine and Pathology (in الإنجليزية). 16 (3): 504–509. doi:10.1007/s12024-020-00247-y. ISSN 1556-2891. PMC 7449996. PMID 32323188.
- ^ "Umbrella stab victim dies of mercury poisoning". www.thelocal.de (in الإنجليزية). 11 May 2012. Retrieved 13 June 2022.
- ^ "Quecksilbervergiftung" [Mercury poisoning]. Der Spiegel (in الألمانية). 11 May 2012. Retrieved 3 September 2020.
- ^ Albers, Anne; Gies, Ursula; Raatschen, Hans-Jurgen; Klintschar, Michael (2020-09-01). "Another umbrella murder? – A rare case of Minamata disease". Forensic Science, Medicine and Pathology (in الإنجليزية). 16 (3): 504–509. doi:10.1007/s12024-020-00247-y. ISSN 1556-2891. PMC 7449996. PMID 32323188.
- ^ "Heimtückischer Mord - Familienvater stirbt nach Spritzenattacke - ZDFmediathek". 2022-08-30. Archived from the original on 30 August 2022. Retrieved 2024-10-27.
وصلات خارجية
- ATSDR – ToxFAQs: Mercury Archived 1 فبراير 2021 at the Wayback Machine
- ATSDR – Public Health Statement: Mercury Archived 24 ديسمبر 2020 at the Wayback Machine
- ATSDR – MMG: Mercury Archived 16 يناير 2021 at the Wayback Machine
- ATSDR – Toxicological Profile: Mercury[dead link]
- National Pollutant Inventory – Mercury and compounds Fact Sheet
- مقالات بالمعرفة بحاجة لذكر رقم الصفحة بالمصدر from January 2025
- CS1 الألمانية-language sources (de)
- Short description is different from Wikidata
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Chemical articles with unknown parameter in Chembox
- Articles with unsourced statements from January 2025
- Articles with dead external links from June 2025
- سموم عصبية
- مركبات زئبق عضوي
- مركبات الميثيل