كلوريد الكالسيوم

| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Calcium chloride
| |
| أسماء أخرى
Calcium(II) chloride,
Calcium dichloride, E509 | |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.030.115 |
| رقم EC |
|
| E number | E509 (acidity regulators, ...) |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | CaCl2 |
| كتلة مولية | 110.98 g/mol (لامائي) 128.999 g/mol (أحادي الهيدرات) 147.014 g/mol (ثنائي الهيدرات) 183.045 g/mol (رباعي الهيدرات) 219.08 g/mol (سداسي الهيدرات) |
| المظهر | white solid |
| الكثافة | 2.15 g/سم3 (لامائي) 1.835 g/cm3 (ثنائي الهيدرات) 1.83 g/cm3 (رباعي الهيدرات) 1.71 g/cm3 (سداسي الهيدرات) |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 74.5 g/100mL (20 °C) 59.5 g/100 mL (0 °C) |
| قابلية الذوبان في alcohol | قابل للذوبان |
| الحموضة (pKa) | 8-9 (anhydrous) 6.5-8.0 (سداسي الهيدرات) |
| البنية | |
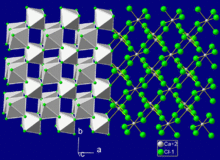
| البنية البلورية | Orthorhombic (deformed rutile), oP6 |
| الزمرة الفراغية | Pnnm, No. 58 |
| هندسة إحداثية |
ثماني الأوجه, 6-coordinate |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Irritant (Xi) |
| توصيف المخاطر | R36 |
| تحذيرات وقائية | (S2), S22, S24 |
| NFPA 704 (معيـَّن النار) | |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
1000 mg/kg (oral, rat) |
| مركبات ذا علاقة | |
أنيونات أخرى
|
فلوريد الكالسيوم بروميد الكالسيوم يوديد الكالسيوم |
كاتيونات أخرى
|
كلوريد المغنسيوم كلوريد السترونشيوم كلوريد الباريوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
كلوريد الكالسيوم مركب كيميائي له الصيغة CaCl2 ، ويكون على شكل صلب ذي لون أبيض.
الخواص
- بلورات كلوريد الكالسيوم لها خاصة استرطاب كبيرة، لذا تستخدم في التجفيف.
- انحلالية مركب كلوريد الكالسيوم جيدة جداً في الماء، حوالي 70 غ لكل 100 مل عند 20°س، وذلك بشكل ناشر للحرارة وذلك نتيجة التشكل الناشر للحرارة لمركب سداسي هيدرات كلوريد الكالسيوم CaCl2.6H2O
- ينحل كلوريد الكالسيوم في الإيثانول أيضاً، حوالي 20 غ كل 100 مل عند 20°س.
التحضير
ينتج من تفاعل حمض هيدروكلوريك HCl مع الحجر الجيري ( كربونات الكالسيوم) CaCO3 ومعادلة التفاعل
- CaCO3+ 2 HCl → CaCl2 + H2O+ CO2
ينتج الشكل الخالي من الماء لمركب كلوريد الكالسيوم من تسخين سداسي الهيدرات بشكل حذر إلى 260°س
الاستخدامات
- نتيجة الشراهة الكبيرة لكلوريد الكالسيوم للماء يدخل التجفيف كتطبيق رئيسي له.
- كما يدخل في العديد من الصناعات الغذائية كمضاف غذائي لها رقم الإي E 509 مثل صناعة المعلبات وفي صناعة الألبان حيث يعمل على معادلة الحموضة ، وعدم تخثر اللبن خلال عملية البسترة، وصناعة المخللات.
- يدخل في استعمالات أخرى مثل التبريد وصناعة البلاستيك وفي إطفاء الحرائق.
- يدخل في صناعة الكوكايين.[2]
انظر أيضاً
الهامش
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ^ Michael Smith and Cam Simpson (2020-10-26). "Narcos Are Waging a New Drug War Over a Texas Company's Basic Chemical". بلومبرگ.
- Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
وصلات خارجية
مشاع المعرفة فيه ميديا متعلقة بموضوع [[commons: Category:Calcium chloride
| Calcium chloride
]].الكلمات الدالة:
This article may include material from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.
تصنيفات:
- Pages using Chembox with unknown parameters
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- CS1 errors: unsupported parameter
- CS1 errors: extra text: edition
- كلوريدات
- مركبات الكالسيوم
- هاليدات فلزية
- مواد مذوبة
- مجففات
- ملونات نارية
- أملاح تؤكل

