خلات الأمونيوم
| خلات الأمونيوم | |
|---|---|
| |
| معلومات عامة | |
| الاسم النظامي | أسيتات الأمونيوم |
| أسماء أخرى | خلات الأمونيوم |
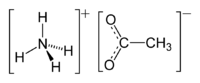
| الصيغة الجزيئية | +CH3COO - NH4 |
| رقم CAS | [631-61-8] |
| الخواص | |
| الكتلة المولية | 77.08 غ/مول |
| المظهر | بلورات عديمة اللون
مسحوق بلوري أبيض |
| الكثافة | 1.07 غ/سم3 صلب |
| الانحلالية في الماء | 148 غ/100 مل ماء عند 4 °س |
| الانحلالية في المحلات الأخرى | ينحل بشكل جيد في الإيثانول |
| درجة الانصهار | 114 °س |
| درجة الغليان | يتفكك |
| في حال عدم ذكر الشروط فإن
البيانات الواردة أعلاه مقاسة في الشروط النظامية ومدونة حسب النظام الدولي للوحدات | |
خلات الأمونيوم أو أسيتات الأمونيوم هو مركب كيميائي له الصيغة المجملة C2H7NO2 ، ويكتب عادة بالصيغة +CH3COO - NH4 . ويكون على شكل بلورات إبرية عديمة اللون، وشغوفة للرطوبة.
الخواص
- ينحل مركب خلات الأمونيوم في الماء بشكل جيد جداً، ومحاليله فيه معتدلة، كما ينحل يشكل جيد في الإيثانول.
- يؤدي تسخين المحاليل المائية لخلات الأمونيوم إلى تفككه لمكوناته الأمونياك و حمض الخل، بالتالي تظهر حموضة متزايدة مع التسخين.
أما بتسخين المركب إلى درجات حرارة أعلى من 100°س لفترة جيدة يؤدي إلى تفككه إلى الأسيتاميد.
التحضير
يحضر مركب خلات الأمونيوم من تفاعل تعديل حمض الخل بالأمونياك أو بـكربونات الأمونيوم وذلك حسب التفاعلات
الاستخدامات
- يستخدم كمعقم ومطهر للجروح.
المصادر
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
| أملاح وإستر أيون الخلات | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||||
| LiOAc | Be(OAc)2 BeAcOH |
B(OAc)3 | ROAc | NH4OAc | AcOAc | FAc | Ne | ||||||||||||
| NaOAc | Mg(OAc)2 | Al(OAc)3 ALSOL Al(OAc)2OH |
Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca(OAc)2 | Sc(OAc)3 | Ti(OAc)4 | VO(OAc)3 | Cr(OAc)2 | Mn(OAc)2 MnAc3 |
Fe(OAc)2 FeAc3 |
Co(OAc)2, CoAc3 |
Ni(OAc)2 | Cu(OAc)2 | Zn(OAc)2 | Ga(OAc)3 | Ge | As | Se | BrAc | Kr | ||
| RbOAc | Sr(OAc)2 | Y(OAc)3 | Zr(OAc)4 | Nb | Mo(OAc)2 | Tc | Ru | Rh | Pd(OAc)2 | AgOAc | Cd(OAc)2 | In | Sn(OAc)2 SnAc4 |
Sb(OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba(OAc)2 | Hf | Ta | W | Re | Os | Ir | Pt(OAc)2 | Au | Hg2(OAc)2, HgAc2 |
TlOAc Tl(OAc)3 |
Pb(OAc)2 Pb(OAc)4 |
Bi(OAc)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La(OAc)3 | Ce(OAc)x | Pr | Nd | Pm | Sm(OAc)3 | Eu(OAc)3 | Gd(OAc)3 | Tb | Dy(OAc)3 | Ho(OAc)3 | Er | Tm | Yb(OAc)3 | Lu(OAc)3 | |||||
| Ac | Th | Pa | UO2(OAc)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
الكلمات الدالة:
This article contains content from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.