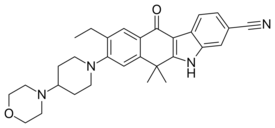
ألستينيب
 | |
| البيانات السريرية | |
|---|---|
| النُطق | []əˈlɛktɪnɪb[] ə-LEK-ti-nib |
| الأسماء التجارية | Alecensa |
| AHFS/Drugs.com | alecensa |
| License data | |
| مسارات الدواء | عن طريق الفم (كپسول) |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية |
|
| بيانات الحركية الدوائية | |
| التوافر الحيوي | 37% (بشروط) |
| ارتباط الپروتين | >99% |
| الأيض | بصفة رئيسية CYP3A4 |
| المستقلبات | M4 (نشط) |
| Elimination half-life | 33 ساعة (ألسنتيب)، 31 ساعة (M4) |
| الإخراج | البراز (98%)[1] |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.256.083 |
| Chemical and physical data | |
| التركيب | C30H34N4O2 |
| الكتلة المولية | 482.62 گ/مول |
| 3D model (JSmol) | |
| |
| |
ألستينيب Alectinib (INN،[2] يباع باسم ألسنسا Alecensa)، هو دواء يؤخذ عن طريق الفم يعمل على منع نشاط anaplastic lymphoma kinase (ALK)[3][4] ويستخدم لعلاج سرطان اللجنة ذو الخلايات الغير صغيرة (NSCLC). طورتها تشوگاي للأدوية، اليابان، وهي جزء من مجموعة هوفمان-لا روش.
الموافقات والاستخدامات الطبية
تمت الموافقة على ألستينيب في اليابان في يوليو 2014[5] لعلاج ALK fusion-gene positive، الغير مستقر سرطان الرئة ذو الخلايا الصغيرة المتقدم أو المتكرر (NSCLC).[4]
تمت الموافقة على الدواء من قبل ادارة الغذاء والدواء في ديسمبر 2015 لعلاج الحالات المصابة ALK-positive NSCLC الذين ازدادت حالتهم سوءاً بعد، أو الذين لا يستطيعون تحمل، العلاج بالكريزوتينيب (إكسالكوري).[3]
حصل على موافقة مشروطة من وكالة الأدوية الأوروپية في فبراير 2017 لعلاج نفس الأعراض. يعني هذا أن هناك المزيد من الدراسات والتي بحاجة لتأكيد نسبة-الخطر-الفائدة الإيجابي.[6]
كانت الموافقات معتمدة بصفة رئيسية على تجربتين: الأولى هي تجربة المرحلة 1-2 اليابانية، بعد حوالي سنتين، 19.6% من المرضى استجابوا بشكل كامل، ونسبة progression-free survival للسنتين كانت 76%.[4] في فبراير 2016، قارنت دراسة المرحلة الثالثة جيه-ألكس دواء الألستينيب والكريزوتينيب والذي كان يستخدم من قبل لأن التحليل المرحلي أظهر أن progression-free survival كان أطول مع استخدام الألستينيب.[7]
موانع الاستخدام
ليس هناك موانع استخدام بموجب الموافقة الأمريكية.[8] لم يكن للموافقة الأوروپية سوى ملاحظة افتراضية عن فرط التحسس كمانع للاستخدام.[9]
الآثار الجانبية
بغض النظر عن الآثار المعدية المعوية الغير محددة مثل الإمساك (في 34% من الحالات) والغثيان (22%)، تشمل الآثار السلبية المشتركة في الدراسات الاستسقاء (التورم؛ 34%)، آلام العضلات (31%)، فقر الدم، اضطرابات الرؤية، الحساسية للضوء والطفح الجلدي (جميعها أقل من 20%).[10] تحدث الآثار الجانبية الخطرة في حوالي 19% من المرضى؛ والقاتلة بنسبة 2.8%.[8]
التداخلات الدوائية
الخصائص الدوائية
آلية العمل
الحركة الدوائية
الكيمياء
المصادر
- ^ "Alecensa (alectinib) Capsules, for Oral Use. Full Prescribing Information" (PDF). Genentech USA, Inc. Retrieved 8 February 2017.
- ^ "International Nonproprietary Names for Pharmaceutical Substances (INN). Recommended International Nonproprietary Names: List 70" (PDF). World Health Organization. p. 279. Retrieved 8 February 2017.
- ^ أ ب New Oral Therapy To Treat ALK-Positive Lung Cancer. Dec 2015
- ^ أ ب ت McKeage, Kate (2014). "Alectinib: A Review of Its Use in Advanced ALK-Rearranged Non-Small Cell Lung Cancer". Drugs. 75 (1): 75–82. doi:10.1007/s40265-014-0329-y. ISSN 0012-6667. PMID 25428710.
- ^ Japan becomes first country to approve Roche’s alectinib for people with a specific form of advanced lung cancer
- ^ "Alecensa authorisation details". European Medicines Agency. 16 February 2017.
- ^ Chugai’s ALK Inhibitor “Alecensa” Trial Stopped Early for Benefit. Feb 2016
- ^ أ ب FDA Professional Drug Information على ألسينسا.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةEMA - ^ Haberfeld, H, ed. (2017). Austria-Codex (in German). Vienna: Österreichischer Apothekerverlag. Alecensa 150 mg Hartkapseln.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةassessment-report
وصلات خارجية
- Alecensa (alectinib) Official Web Site
- Alectinib UK Medicines Information
